4000. Proteinstruktur an BESSY II entschlüsselt
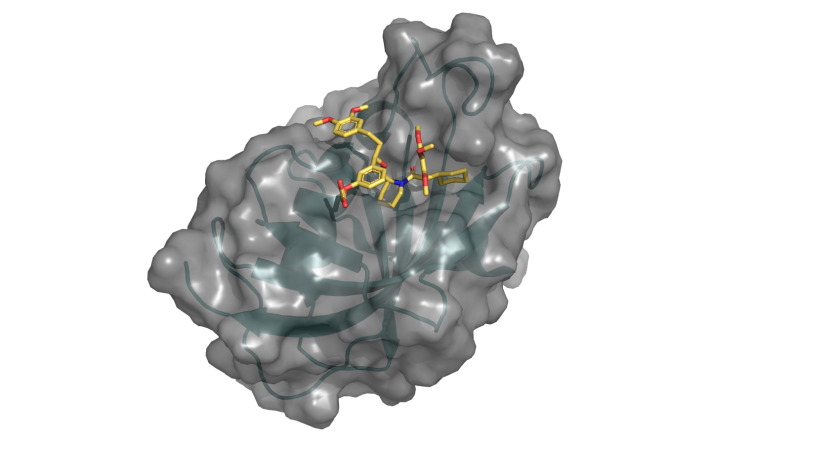
Die 4000. Proteinstruktur aus dem HZB BESSY, die in der PDB veröffentlicht wurde, zeigt die G64S-Variante von FKBP51 im Komplex mit dem hochselektiven Liganden SAFit (eingezeichnete Struktur). © C. Meyners/TU Darmstadt/HZB
Bei der 4000. Struktur handelt es sich um das Molekül FKBP51, das mit stressinduzierten Erkrankungen wie Depressionen, chronischen Schmerzen und Diabetes zusammenhängt. Das Team um Prof. Dr. Felix Hausch, TU Darmstadt, nutzt die Kenntnis der dreidimensionalen Struktur, um neue Strategien für das Design passender Medikamente zu entwickeln.
Viele Erkrankungen hängen mit Fehlfunktionen von Proteinen im Organismus zusammen. Die dreidimensionale Architektur dieser Moleküle ist oft äußerst komplex, liefert aber wertvolle Hinweise, wie sich die Fehlfunktion beheben ließe, beispielsweise durch Medikamente, die sich perfekt in eine „Tasche“ an das Zielmolekül binden und die Fehlfunktion blockieren. Die Struktur von Proteinen lässt sich mit Röntgenanalysen an den MX-Beamlines von BESSY II entschlüsseln.
In der Protein Data Bank (www.rcsb.org/pdb), die alle experimentell bestimmten Proteinstrukturen enthält, ist nun die 4000. Struktur aus BESSY II eingetragen worden. Das Team um Prof. Felix Hausch von der TU Darmstadt hatte Proteinkristalle aus dem Molekül FKBP51 hergestellt und an den MX-Beamlines untersucht.
Dabei handelt es sich um ein Protein, das eine besondere Rolle bei den großen Gesundheitsproblemen unserer Zeit spielt. Denn FKBP51 reguliert die Signaltransduktion von Steroidhormonrezeptoren, die durch Stress gestört sein kann. Dies kann Depressionen, chronische Schmerzen oder Krankheiten wie Diabetes und Übergewicht auslösen. Das Protein FKBP51 hat sich als vielversprechender Angriffspunkt für Medikamente gegen diese Krankheiten erwiesen. „Die Proteinstrukturanalyse zeigt uns, wo im Molekül interessante „Taschen“ sitzen, die als Zielpunkte für Medikamente in Frage kommen“, sagt Dr. Christian Meyners, TU Darmstadt.
arö
https://www.helmholtz-berlin.de/pubbin/news_seite?nid=24367;sprache=de
- Link kopieren
-
Größte bisher bekannte magnetische Anisotropie eines Moleküls gemessen
An der Berliner Synchrotronstrahlungsquelle BESSY II ist es gelungen, die größte magnetische Anisotropie eines einzelnen Moleküls zu bestimmen, die jemals experimentell gemessen wurde. Je größer diese Anisotropie ist, desto besser eignet sich ein Molekül als molekularer Nanomagnet. Solche Nanomagnete besitzen eine Vielzahl von potenziellen Anwendungen, z. B. als energieeffiziente Datenspeicher. An der Studie waren Forschende aus dem Max-Planck-Institut für Kohlenforschung (MPI KOFO), dem Joint Lab EPR4Energy des Max-Planck-Instituts für Chemische Energiekonversion (MPI CEC) und dem Helmholtz-Zentrums Berlin beteiligt.
-
Ultraschnelle Dissoziation von Molekülen an BESSY II analysiert
Ein internationales Team hat an BESSY II erstmals beobachtet, wie schwere Moleküle (Bromchlormethan) in kleinere Fragmente zerfallen, wenn sie Röntgenlicht absorbieren. Mit einer neu entwickelten Analysemethode gelang es ihnen, die ultraschnelle Dynamik dieses Prozesses sichtbar zu machen. Dabei lösen die Röntgenphotonen einen „molekularen Katapulteffekt“ aus: Leichte Atomgruppen werden zuerst herausgeschleudert, ähnlich wie Geschosse, die von einem Katapult abgeschossen werden, während die schwereren Atome – Brom und Chlor – sich deutlich langsamer trennen.
-
Batterieforschung mit dem HZB-Röntgenmikroskop
Um die Kapazität von Lithiumbatterien weiter zu steigern, werden neue Kathodenmaterialien entwickelt. Mehrschichtige lithiumreiche Übergangsmetalloxide (LRTMO) ermöglichen eine besonders hohe Energiedichte. Mit jedem Ladezyklus wird jedoch ihre Kapazität geringer, was mit strukturellen und chemischen Veränderungen zusammenhängt. Mit Röntgenuntersuchungen an BESSY II hat nun ein Team aus chinesischen Forschungseinrichtungen diese Veränderungen erstmals experimentell mit höchster Präzision vermessen: Mit dem einzigartigen Röntgenmikroskop konnten sie morphologische und strukturelle Entwicklungen auf der Nanometerskala beobachten und dabei auch chemische Veränderungen aufklären.
