Göttinger Wissenschaftler entschlüsseln am BESSY II grundlegende Wirkprinzipien biochemischer Reaktionen
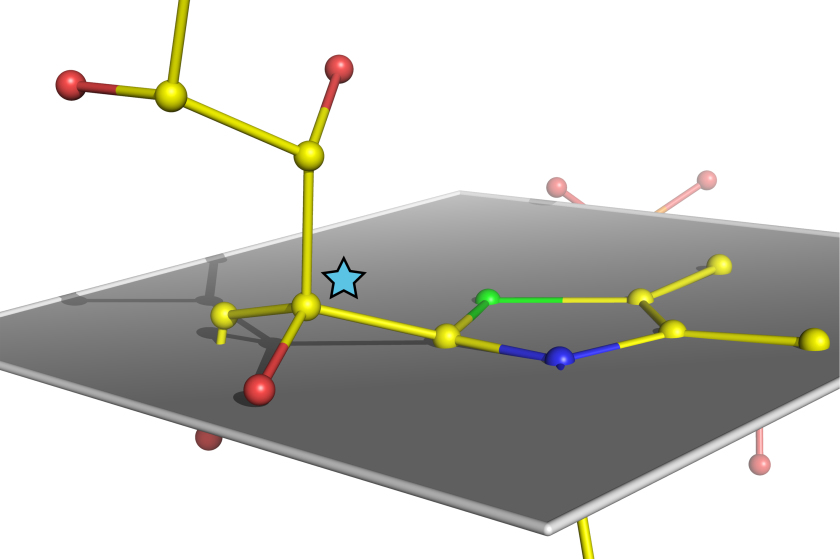
Atomare Struktur eines verbogenen, kurz vor der Spaltung stehenden Zuckermoleküls im humanen Enzym Transketolase.
Enzyme sind die molekularen Katalysatoren des Lebens mit vitalen Funktionen im Stoffwechsel jeder Zelle. Bisher wurde spekuliert, dass Enzyme bei der Durchführung biochemischer Reaktionen ihre Ausgangsstoffe regelrecht verbiegen und dadurch spalten können. Wissenschaftlern am Göttinger Zentrum für Molekulare Biowissenschaften (GZMB) ist es nun erstmals gelungen, diese Hypothese zweifelsfrei zu bestätigen. Dazu nutzten sie die MX-Beamline an BESSY II. Die Ergebnisse der Studie sind in der renommierten Fachzeitschrift Nature Chemistry erschienen.
Die Göttinger Wissenschaftler unter der Leitung von Prof. Dr. Kai Tittmann und Prof. Dr. Ralf Ficner züchteten zunächst hochgeordnete Proteinkristalle des humanen Enzyms Transketolase, das eine Schlüsselrolle bei der Verwertung von Zuckern im menschlichen Stoffwechsel einnimmt. Diese Proteinkristalle versetzten sie mit den natürlichen Zuckersubstraten. Die Analyse der Struktur des Enzymkristalls erfolgte anschließend an der MX-Beamline des Elektronenspeicherrings BESSY II und im französischen Grenoble. Den Wissenschaftlern gelang es, eine ultrahochaufgelöste Struktur des im Enzym gebundenen Zuckermoleküls unmittelbar vor seiner Spaltung in zwei Teile, mit einer extrem hohen Ortsauflösung von 0,1 Nanometer zu bestimmen. „Dieser in seiner Schärfe bis heute einmalige Schnappschuss eines arbeitenden Enzyms offenbart unzweifelhaft, dass das Zuckersubstrat im Enzym verbogen wird wie ein eingespanntes Werkstück in einem Schraubstock“, sagt Prof. Tittmann.
Enzyme stellen oft Angriffspunkte für Medikamente dar. Deshalb sind die neuen Erkenntnisse wichtig für die Entwicklung maßgeschneiderter, hochspezifischer Wirkstoffe, wie zum Beispiel für die Krebstherapie. „Auch die in der vorliegenden Studie untersuchte humane Transketolase übt eine Schlüsselfunktion im Stoffwechsel von Krebszellen aus“, sagt Prof. Tittmann.
Quelle: Universität Göttingen
https://www.helmholtz-berlin.de/pubbin/news_seite?nid=13800;sprache=en),
- Link kopieren
-
Neues Instrument bei BESSY II: Die OÆSE-Endstation in EMIL
An BESSY II steht nun ein neues Instrument zur Untersuchung von Katalysatormaterialien, Batterieelektroden und anderen Energiesystemen zur Verfügung: die Operando Absorption and Emission Spectroscopy on EMIL (OÆSE) Endstation im Energy Materials In-situ Laboratory Berlin (EMIL). Ein Team um Raul Garcia-Diez und Marcus Bär hat die Leistungsfähigkeit des Instruments an elektrochemisch abgeschiedenem Kupfer demonstriert.
-
Grüner Wasserstoff: Käfigstruktur verwandelt sich in effizienten Katalysator
Clathrate zeichnen sich durch eine komplexe Käfigstruktur aus, die auch Platz für Gast-Ionen bietet. Nun hat ein Team erstmals untersucht, wie gut sich Clathrate als Katalysatoren für die elektrolytische Wasserstoffproduktion eignen. Das Ergebnis: Effizienz und Robustheit sind sogar besser als bei den aktuell genutzten Nickel-basierten Katalysatoren. Dafür fanden sie auch eine Begründung. Messungen an BESSY II zeigten, dass sich die Proben während der katalytischen Reaktion strukturell verändern: Aus der dreidimensionalen Käfigstruktur bilden sich ultradünne Nanoblätter, die maximalen Kontakt zu aktiven Katalysezentren ermöglichen. Die Studie ist in „Angewandte Chemie“ publiziert.
-
Katalyseforschung mit dem Röntgenmikroskop an BESSY II
Anders als in der Schule gelernt, verändern sich manche Katalysatoren doch während der Reaktion: So zum Beispiel können bestimmte Elektrokatalysatoren ihre Struktur und Zusammensetzung während der Reaktion verändern, wenn ein elektrisches Feld anliegt. An der Berliner Röntgenquelle BESSY II gibt es mit dem Röntgenmikroskop TXM ein weltweit einzigartiges Instrument, um solche Veränderungen im Detail zu untersuchen. Die Ergebnisse helfen bei der Entwicklung von innovativen Katalysatoren für die unterschiedlichsten Anwendungen. Ein Beispiel wurde neulich in Nature Materials publiziert. Dabei ging es um die Synthese von Ammoniak aus Abfallnitraten.
