Neuer Detektor beschleunigt die Proteinkristallographie
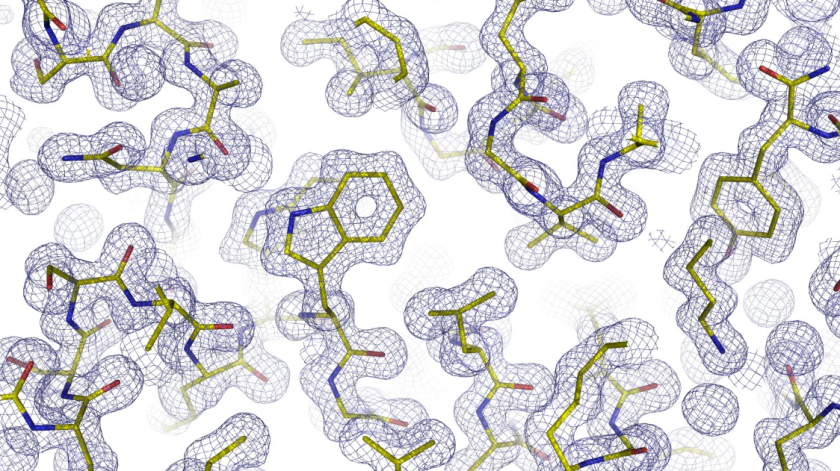
Nur 60 Sek. Messzeit mit dem neuen Detektor reichten schon aus, um die Elektrondichte des PETase-Enzyms zu ermitteln. Sie zeigt alle strukturellen Merkmale des Enzyms. © HZB

Der neue PILATUS-Detektor wurde an der MX-Beamline 14.1 in Betrieb genommen. © HZB
An einer der drei MX-Beamlines am HZB wurde letzte Woche ein neuer Detektor installiert. Im Vergleich zum alten Detektor ist der neue besser, schneller und empfindlicher. Er ermöglicht es, binnen kürzester Zeit vollständige Datensätze von komplexen Proteinen aufzunehmen.
Proteine bestehen aus tausenden von Bausteinen, die komplexe Architekturen mit gefalteten oder verwickelten Bereichen bilden können. Für die Funktion des Proteins im Organismus spielt ihre Gestalt jedoch die entscheidende Rolle. Mit Hilfe der makromolekularen Kristallographie an BESSY II ist es möglich, die Architektur von Proteinmolekülen zu entschlüsseln. Dafür werden winzige Proteinkristalle mit Röntgenlicht aus der Synchrotronquelle BESSY II durchleuchtet. Aus den gewonnenen Beugungsmustern lässt sich die Morphologie der Moleküle errechnen.
Nun hat das MX-Team an BESSY II an der MX-Beamline 14.1 einen neuen Detektor in Betrieb genommen, der zwei- bis dreimal schneller als bisher arbeitet. Als Probe analysierte das Team einen Kristall aus dem Enzym PETase. PETase ist in der Lage, den Kunststoff PET teilweise abzubauen. In weniger als einer Minute konnte der Detektor einen vollständigen Beugungsdatensatz aufzeichnen, der Daten aus einem Winkelbereich von 180 Grad umfasst. Der Datensatz besteht aus 1200 Bildern, die jeweils 45 Millisekunden lang der Röntgenstrahlung ausgesetzt waren. „Die resultierende Elektronendichte war von ausgezeichneter Qualität und zeigte alle strukturellen Merkmale des Enzyms“, erklärt Dr. Manfred Weiss, der das MX-Team an BESSY II leitet.
Der Erfolg der HZB MX-Beamlines wird durch mehr als 3000 PDB-Einträge aus experimenteller Strahlzeit von mehr als hundert internationalen Nutzergruppen aus dem akademischen Bereich und pharmazeutischen Forschungsunternehmen dokumentiert.
red.
https://www.helmholtz-berlin.de/pubbin/news_seite?nid=21100;sprache=dehttp://
- Link kopieren
-
Durchbruch: Erster Elektronenstrahl im SEALab bringt Beschleunigerphysik voran
Weltweit zum ersten Mal hat das SEALab-Team am HZB in einem supraleitenden Hochfrequenzbeschleuniger (SRF Photoinjektor) einen Elektronenstrahl aus einer Multi-Alkali-Photokathode (Na-K-Sb) erzeugt und auf relativistische Energien beschleunigt. Dies ist ein echter Durchbruch und eröffnet neue Optionen für die Beschleunigerphysik.
-
Optische Innovationen für Solarmodule – Was bringt den Ausbau am meisten voran?
Im Jahr 2023 erzeugten Photovoltaikanlagen weltweit mehr als 5% der elektrischen Energie und die installierte Leistung verdoppelt sich alle zwei bis drei Jahre. Optische Technologien können die Effizienz von Solarmodulen weiter steigern und neue Einsatzbereiche erschließen, etwa in Form von ästhetisch ansprechenden, farbigen Solarmodulen für Fassaden. Nun geben 27 Fachleute einen umfassenden Überblick über den Stand der Forschung und eine Einschätzung, welche Innovationen besonders zielführend sind. Der Bericht, der auch für Entscheidungsträger*innen in der Forschungsförderung interessant ist, wurde von Prof. Christiane Becker und Dr. Klaus Jäger aus dem HZB koordiniert.
-
Katalyseforschung mit dem Röntgenmikroskop an BESSY II
Anders als in der Schule gelernt, verändern sich manche Katalysatoren doch während der Reaktion: So zum Beispiel können bestimmte Elektrokatalysatoren ihre Struktur und Zusammensetzung während der Reaktion verändern, wenn ein elektrisches Feld anliegt. An der Berliner Röntgenquelle BESSY II gibt es mit dem Röntgenmikroskop TXM ein weltweit einzigartiges Instrument, um solche Veränderungen im Detail zu untersuchen. Die Ergebnisse helfen bei der Entwicklung von innovativen Katalysatoren für die unterschiedlichsten Anwendungen. Ein Beispiel wurde neulich in Nature Materials publiziert. Dabei ging es um die Synthese von Ammoniak aus Abfallnitraten.
